Colágeno
El colágeno es una proteína que se produce naturalmente en el cuerpo y es la base de nuestra piel, cabello y huesos.
Se encarga de que nuestra piel se mantenga saludable, joven y tersa. Debido a que se forma naturalmente en nuestros cuerpos, la producción de colágeno comienza a disminuir a medida que envejecemos. Otros factores, como la exposición al sol, el tabaquismo o el consumo de azúcar, también contribuyen a la pérdida de colágeno. Esta pérdida de colágeno dará como resultado líneas finas y arrugas, así como pérdida de tersura y brillo.
Nuestro sérum de colágeno estimula la producción de colágeno y da a tu piel una apariencia más suave y tersa.
El sérum de colágeno se puede usar en combinación con todos nuestros otros sérums.
Utilizamos colágeno BioStine HP (f) de la empresa Bio-Nest, Taiwán. El colágeno BioStine HP (f) se origina a partir de escamas de pescado, que contienen principalmente colágeno tipo I. Esta materia prima consiste en colágeno hidrolizado y polisacárido Euglena gracilis, que son carbohidratos complejos del alga Euglena gracilis.
PRODUCTOS CON COLÁGENO
TODO LO QUE NECESITAS SABER
ACERCA DEL COLÁGENOEl colágeno es un grupo de 28 tipos diferentes de proteínas y es la proteína más común en el reino animal. En términos evolutivos, el colágeno es una proteína muy «vieja»; por ejemplo, se ha encontrado colágeno intacto en fósiles de Tyrannosaurus rex de hace 68 millones de años. En el cuerpo humano, el colágeno constituye aproximadamente el 30 % de la masa proteica total y aproximadamente el 75 % del peso seco de la piel es colágeno. El colágeno se encuentra principalmente en el tejido conectivo, por ejemplo, en huesos, cartílagos, tendones, articulaciones y piel.
Los 28 tipos de colágeno se indican con números romanos según su descubrimiento: hay, por ejemplo, colágeno I (el prototipo que se descubrió primero), colágeno II, colágeno III, etc. Se pueden dividir en 8 familias, de las cuales, por ejemplo, el colágeno I y III pertenecen a los colágenos formadores de fibrillas, mientras que, por ejemplo, el colágeno XIII pertenece a los colágenos de transmembrana. Común a todos los colágenos, lo que define a una molécula de colágeno, es una estructura especial en la molécula llamada triple hélice, que consta de tres hebras de cadenas de aminoácidos (péptidos) que se enroscan entre sí y forman una estructura muy estable. Lo que diferencia principalmente a los 28 tipos de colágeno son los otros segmentos (dominios) que se encuentran en las estructuras proteicas y las estructuras tridimensionales que forman. La estructura de triple hélice forma así una parte mayor o menor de los tipos de colágeno; por ejemplo, el colágeno I consta de un 96 % de estructura de triple hélice, mientras que en el colágeno XII es de menos del 10 %.
PROPIEDADES DEL COLÁGENO DE LA PIEL
En la piel, el 70-90 % del colágeno es del tipo colágeno I, mientras que el 10-20 % es colágeno III; hay cantidades más pequeñas de, por ejemplo, colágeno V, VII y XVII. Se encuentran especialmente en la matriz extracelular (entre las células) junto con otras sustancias como la elastina y los glicosaminoglicanos (p. ej., hialuronatos y dermatán sulfato), donde, entre otras cosas, dan estructura y elasticidad a la piel. El colágeno también es importante en el proceso de cicatrización de heridas. Esto se ve, por ejemplo, en la enfermedad del escorbuto, donde se presentan síntomas como sangrado de las encías y falta de cicatrización de heridas porque la falta de vitamina C significa que no se produce el colágeno adecuado, ya que la vitamina C es un cofactor importante para ciertas enzimas que juegan un papel decisivo en la formación de la estructura de triple hélice en el colágeno. También hay un gran número de otras enfermedades que son causadas por errores en la formación de colágeno o mutaciones genéticas directas en los genes del colágeno.
¿QUÉ LE OCURRE AL COLÁGENO CUANDO LA PIEL ENVEJECE?
Hay una cierta conversión (rotación) del colágeno, que se controla con bastante precisión y varía con la edad. El colágeno y la elastina son proteínas bastante estables, cuya vida media se mide en años; por lo tanto, cada molécula está expuesta parcialmente en su trayectoria y acumula continuamente pequeños daños en su estructura, lo que perjudica su función. Las metaloproteinasas de matriz (MMP) son las enzimas que inician la descomposición del colágeno; por ejemplo, el colágeno I, II y III se parten en MMP-1, MMP-8 y MMP-13, después de lo cual otras enzimas degradantes continúan trabajando con los componentes del colágeno. La actividad de las enzimas MMP está asociada con la radiación UV, y el estrés oxidativo en la piel con radicales libres. A medida que envejecemos, la producción y la calidad del colágeno en la piel disminuyen. El contenido de colágeno alcanza su punto máximo alrededor de los 30 años, y luego la cantidad se reduce en aproximadamente un 1-1,5 % por año, junto con los componentes extracelulares asociados, de modo que cuando tienes alrededor de 70 años, la cantidad es aproximadamente el 25 % del máximo. La disminución en el contenido de colágeno y la calidad del colágeno se correlaciona con el envejecimiento de la piel, como las arrugas.
BIOSÍNTESIS DEL COLÁGENO
Las proteínas se sintetizan de acuerdo con el mismo procedimiento básico: El dogma central, que describe cómo se sintetizan las proteínas a partir de la información genética contenida en el ADN. Brevemente: el gen en el ADN (después de la llegada de una señal) «se abre» para que pueda copiarse (transcribirse) en una molécula de ARN llamada ARN mensajero (ARNm). Esto sucede dentro del núcleo celular. La molécula de ARNm ingresa en el citoplasma de la célula, donde unidades especiales llamadas ribosomas traducen el código de ARNm en aminoácidos, que se unen para formar una cadena peptídica, una larga cadena de aminoácidos. En algunos, se modifica ligeramente (modificación postraduccional), después de lo cual se pliega en una estructura tridimensional completamente específica, posiblemente junto con otras cadenas peptídicas para formar la proteína final. Así, las proteínas son generalmente moléculas muy grandes que pueden estar formadas por varias cadenas peptídicas.
En la siguiente descripción de la síntesis de colágeno y su estructura, centraremos la atención en el colágeno I, que es el colágeno más extendido en la piel.
Los fibroblastos son células de la piel en la dermis que producen la mayor parte del colágeno I de la piel. En la superficie de la célula hay una gran cantidad de receptores, algunos de los cuales pueden unirse a moléculas de señalización que conducen a la activación de la célula e inician el proceso de producción de colágeno. Dentro del núcleo celular, los genes específicos para las tres cadenas peptídicas se transcriben en ARNm, que luego se conduce al citoplasma de la célula, donde se traducen a través de los ribosomas en aminoácidos, que se juntan para formar cadenas peptídicas.
Cada cadena peptídica consta de 1050 aminoácidos; el colágeno I consta de dos cadenas α1(I) y una cadena α2(I) (otros colágenos constan de tres cadenas idénticas o tres cadenas diferentes). Lo especial del colágeno es que la frecuencia de aminoácidos que generalmente se repite a lo largo de la cadena es glicina-XY, donde X e Y suelen ser los aminoácidos prolina e hidroxiprolina; esta secuencia de aminoácidos es la decisiva para la formación de la importante estructura de triple hélice. Las cadenas peptídicas se conducen directamente a un orgánulo del sistema de membrana llamado retículo endoplásmico, donde las tres cadenas peptídicas de procolágeno experimentan una serie de procesos (modificaciones postraduccionales); entre otras cosas, la glicosilación, donde ciertas moléculas de azúcar se colocan en ciertas posiciones, la hidroxilación de ciertos aminoácidos de prolina y lisina y, finalmente, los enlaces disulfuro entre las tres cadenas, lo hace que se unan en la conocida triple hélice dextrógira, algo así como una cremallera. Luego, este procolágeno sale de la célula a través de una vesícula hacia el espacio extracelular, donde las enzimas extracelulares eliminan los extremos del procolágeno. Esto da como resultado la estructura llamada tropocolágeno, que para el colágeno I consiste básicamente en una triple hélice que tiene 300 nm de largo y aproximadamente 1,5 nm de diámetro. Esta eliminación de los extremos permite que la molécula pueda formar enlaces (crosslinks) con otras hélices triples de colágeno I y así formar estructuras más grandes llamadas fibrillas de colágeno, que tienen una estructura especial que aparece en microscopía electrónica como una estructura rayada. Las fibrillas de colágeno I tienen un diámetro de 50-200 nm. Las fibrillas pueden luego ensamblarse en estructuras de fibra de colágeno I aún más grandes, que, por ejemplo, en los tendones tienen hasta 1 cm de largo y 500 nm de diámetro.
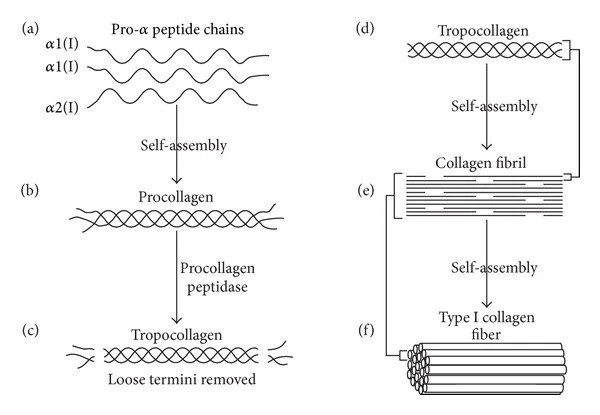
Figura 1 Biosíntesis de colágeno I: (a) Dos cadenas peptídicas idénticas α1(I) y una α2(I) se ensamblan para formar procolágeno (b). (c) La enzima procolágeno peptidasa elimina los extremos «sueltos» para formar así tropocolágeno (d). La molécula de tropocolágeno se ensambla con otros tropocolágenos y, por lo tanto, forma fibra de colágeno I en crecimiento. Estas fibrillas de colágeno pueden entonces juntas formar fibra de colágeno I (f). Esta figura es del artículo Collagen Scaffolds in Bone Sialoprotein-Mediad Bone Regeneration de Kruger, TE; Miller, AH; Wang, J. Publicado en The Scientific World Journal, volumen 2013, ID de artículo 812718, 6 páginas, 2013.
COLÁGENO EN COSMÉTICA
El colágeno es una estructura muy grande e insoluble en sí misma, que no puede atravesar la piel, pero sí formar una película (estructura cohesiva) que reduce la pérdida de agua de la piel y, por lo tanto, actúa como un retenedor de humedad, también porque el colágeno puede retener el agua.
En muchos casos, en cosmética se usa el colágeno hidrolizado, que generalmente primero se ha desnaturalizado y luego se ha descompuesto enzimáticamente en partes más pequeñas, las cuales pueden variar mucho en tamaño y capacidad para penetrar en la piel. Por ejemplo, se ha demostrado que algunos hidrolizados de colágeno tienen propiedades antioxidantes, hidratantes y reparadoras de la piel dañada.
Hay varias fuentes naturales de colágeno: el cerdo, el ganado bovino y los animales marinos como los peces. El colágeno bovino está fácilmente disponible y es útil para algunos fines biomecánicos, pero desafortunadamente es bastante heterogéneo. También puede ser inmunogénico (puede provocar una reacción inmune), y perder su integridad estructural durante el proceso de aislamiento. Además, como con el colágeno porcino, existe el riesgo de enfermedades zoonóticas, como la EEB (encefalopatía espongiforme bovina, enfermedad de las vacas locas). El colágeno de origen marino es menos termoestable, pero tiene propiedades que lo hacen interesante para la cosmética. Al igual que con otras fuentes naturales, existe el riesgo de variaciones entre lotes que pueden ser difíciles de controlar.
Otro camino a seguir es sintetizar péptidos más pequeños en el laboratorio con la misma secuencia (o similar) de aminoácidos que el colágeno; estos pueden ser dipéptidos o tripéptidos pequeños (que constan de dos o tres aminoácidos), o estructuras más grandes que pueden formar triples hélices similares a las del colágeno. Otra forma es producir células modificadas genéticamente (p. ej., células de cebada o de la planta del tabaco), que pueden producir colágeno en condiciones más controladas.
EL USO DEL COLÁGENO
Además del uso cosmético, el colágeno se usa en muchos otros contextos, por ejemplo, como relleno, inyectando una pequeña cantidad de colágeno en la piel para corregir arrugas, y en contextos médicos, para curar heridas. El colágeno también está disponible como suplementos alimentarios (normalmente junto con una serie de vitaminas y otras sustancias naturales) para la mejora de la estructura de la piel. Algunos estudios muestran efectos sobre la piel con suplementos alimentario de alta complejidad que incluyen colágeno. La teoría subyacente es que después de la ingestión, el colágeno se descompone en el estómago principalmente en aminoácidos, alrededor del 10 % se convierte en pequeños dipéptidos y tripéptidos, que se absorben en la sangre y se distribuyen por todo el cuerpo, por ejemplo, en la piel, donde las células pueden utilizar los aminoácidos como «bloques de construcción» para la biosíntesis de colágeno. Los estudios muestran que los dipéptidos con hidroxiprolina pueden estimular los fibroblastos a través de los receptores y así inducir la síntesis de colágeno.
FUENTES:
Aguirre-Cruz, G.; León-López, A.; Cruz-Gómez ,V.; Jiménez-Alvarado, R., Aguirre-Álvarez, G. Collagen Hydrolysates for Skin Protection: Oral Administration and Topical Formulation. Antioxidants (Basel). 2020 Feb 22;9(2):181.
Avila Rodríguez, M. I.; Rodríguez Barroso, L.G.; Sanchez, M. L. Collagen: A review on its sources and potential cosmetic applications. Journal of Cosmetic Dermatology 2018; 17: 20-26.
Kruger, T. E.; Miller, A. H.; Wang, J. Collagen Scaffolds in Bone Sialoprotein-Mediated Bone Regeneration. The Scientific World Journal, vol. 2013, Article ID 812718, 6 pages, 2013
Lodish, H., Berk, A.; Zipursky, S.L., et al. Molecular Cell Biology. 4th edition. New York: W. H. Freeman; 2000. Section 22.3, Collagen: The Fibrous Proteins of the Matrix.
Lokaliseret 19. Juli 2021: https://www.ncbi.nlm.nih.gov/books/NBK21582
Reilly, D.M.; Lozano, J. Skin collagen through the lifestages: importance for skin health and beauty. Plastic and Aesthetic Research 2021; 8:2.
Ricard-Blum, S. The collagen family. Cold Spring Harbor perspectives in biology. 2011 Jan 1;3(1):a004978.
Shoulders, M.D.; Raines, R.T. Collagen structure and stability. Annual review of biochemistry, 2009, vol. 78, 929–958.
Sionkowska, A.; Adamiak, K.; Musiał, K.; Gadomska, M. Collagen Based Materials in Cosmetic Applications: A Review. Materials 2020, 13, 4217.




