Aminoácidos
Aminoácidos: las pequeñas sustancias que forman la vida
Los aminoácidos son pequeñas moléculas orgánicas que desempeñan un papel crucial en todos los seres vivos. Además de ser elementos básicos de todos los péptidos y proteínas, cumplen muchas funciones por sí mismos. Algunos aminoácidos actúan como moléculas de señalización y otros son precursores de otras sustancias importantes, como los neurotransmisores y las hormonas.
Las proteínas pueden describirse como las «moléculas obreras» del organismo. Posibilitan prácticamente todos los procesos bioquímicos. Algunos ejemplos de proteínas son:
-
Hemoglobina, que transporta el oxígeno en la sangre
Queratina, que constituye la mayor parte del cabello y las uñas y, junto con las proteínas colágeno y elastina, es esencial para la estructura y el funcionamiento de la piel.
Actina y miosina, responsables de la contracción muscular
Receptores y canales iónicos que transmiten señales
Anticuerpos del sistema inmunitario
-
Enzimas que descomponen los nutrientes y facilitan las reacciones bioquímicas vitales.
Los péptidos también son indispensables para la vida y tienen una gran variedad de propiedades, como antimicrobianas, antivirales, inmunomoduladoras y antiinflamatorias1.
En total, hay 20 aminoácidos estándar, comunes a toda la vida en la Tierra y que están codificados directamente en el material genético: el ADN. Además, existen aminoácidos especiales como la selenocisteína y la pirrolisina que, en los seres humanos, por ejemplo, pueden incorporarse a las proteínas mediante mecanismos particulares; además, también existe una gran variación en los aminoácidos entre distintos organismos. Se han identificado más de 300 aminoácidos diferentes en la naturaleza. Algunos de los 20 aminoácidos estándar son esenciales para el ser humano y deben obtenerse a través de la dieta.
Otros son aminoácidos condicionalmente esenciales (también conocidos como semiesenciales), que son necesarios en determinados casos, mientras que el resto no son esenciales, ya que el organismo puede sintetizarlos por sí mismo en cantidades suficientes. Buenas fuentes de aminoácidos en los alimentos son, por ejemplo, la carne, los huevos, el pescado, los productos lácteos y las legumbres.
Los aminoácidos no solo desempeñan una gran variedad de funciones en la naturaleza, sino que también se utilizan ampliamente en distintas industrias y productos, sobre todo en alimentación, piensos, medicamentos, suplementos alimentarios y cosméticos. Además de utilizarse directamente como aminoácidos, también sirven como punto de partida para la producción de otras sustancias; por ejemplo, para la producción de tensioactivos relativamente suaves (surfactantes) e ingredientes para el cuidado del cabello.
Sin aminoácidos, la vida en la Tierra no existiría, pues ellos son los componentes básicos de la química de la vida. Son esenciales para la formación de proteínas, péptidos y muchas otras sustancias vitales para todos los organismos vivos conocidos.
Por ejemplo, PUCA PURE & CARE utiliza en sus productos los aminoácidos arginina, prolina y serina, así como la glicina para la producción del tensioactivo relativamente suave cocoilglicinato de potasio, y varios de sus productos contienen péptidos y proteínas vegetales hidrolizadas.
1Encontrará más información sobre los péptidos en nuestro sitio
Aminoácidos: descubrimientos y dogma central
Los aminoácidos se descubrieron hace más de 200 años. En 1806 se consiguió aislar por primera vez un aminoácido de los espárragos, sustancia que posteriormente se denominó asparagina. En las décadas siguientes, se fueron identificando gradualmente el resto de los aminoácidos y se describieron sus estructuras químicas. El último de los 20 aminoácidos estándar, la treonina, se descubrió en 1935.
A principios del siglo XX se halló que las proteínas y los péptidos están formados por aminoácidos. Esta idea sentó las bases de la comprensión de las proteínas como macromoléculas biológicas, y fue un paso importante hacia lo que más tarde se conoció como el dogma central de la biología molecular: que la información genética del ADN se transcribe (reescribe) en ARN y luego se transpone (traduce) en proteínas.
Este proceso fundamental y energético comienza con la transcripción, en la que un gen del ADN de la célula actúa como molde para producir ARN mensajero (ARNm). A continuación, el ARNm se transporta a los ribosomas (las complejas fábricas de proteínas de la célula), donde tiene lugar la traducción de ARNm a cadena de aminoácidos. El ARNm está formado por una cadena de nucleótidos2, cuyas cuatro bases posibles llevan el código genético.
Las cuatro bases posibles son adenina (A), guanina (G), citosina (C) y uracilo (U), y se leen en conjuntos de tres llamados codones.
Así, un codón es una combinación de tres de los cuatro nucleótidos posibles, y puede haber 64 codones. Algunos de ellos actúan como señal de parada en el proceso de traducción, mientras que la mayoría codifican un aminoácido específico, y también hay varios que codifican el mismo aminoácido: por ejemplo, los cuatro codones GCT, GCC, GCA y GCG codifican el aminoácido alanina, mientras que hay seis codones que codifican la arginina: CGU, CGC, CGA, CGG, AGA y AGG.
La lectura (traducción) de ARNm a aminoácido se realiza mediante las llamadas moléculas de ARN de transferencia (ARNt), que actúan como adaptador: reconocen un codón específico en el ARNm y llevan el aminoácido correspondiente al ribosoma. Aquí, los aminoácidos se unen uno a uno mediante enlaces peptídicos3, formando una cadena que luego se pliega y modifica para convertirse en una proteína funcional.
2Los nucleótidos son los componentes básicos del ADN y el ARN. Un nucleótido está formado por una molécula de azúcar (desoxirribosa en el ADN y ribosa en el ARN), un grupo fosfato y una base nitrogenada. En el ADN y el ARN, estos nucleótidos se unen formando largas cadenas.
3Un enlace peptídico es la unión entre aminoácidos para formar proteínas. Esta unión es un enlace amida entre el grupo carboxilo ácido de un aminoácido y el grupo amina de otro aminoácido.
Aminoácidos: estructura química
Los aminoácidos son un grupo de biomoléculas que contienen dos grupos funcionales centrales: un grupo amino básico (-NH₂) y un grupo carboxilo ácido (-COOH). Además, cada aminoácido tiene una cadena lateral, a menudo denominada grupo R, que varía de un aminoácido a otro. Este grupo R es, justamente, el que confiere a cada aminoácido sus propiedades especiales.
La posición del grupo amino en relación con el grupo carboxilo determina el tipo de aminoácido. Si el grupo amino está unido al mismo átomo de carbono que el grupo carboxilo (el átomo de C marcado con «α» en la fórmula estructural de la figura 1), se denomina alfa-aminoácido. Si el grupo amino está en un átomo C más alejado del grupo carboxilo, podemos hablar de beta- o gamma-aminoácidos. En biología y química, cuando hablamos de «aminoácidos», casi siempre nos referimos a los alfa aminoácidos. Los 20 aminoácidos estándar que se encuentran en las proteínas son aminoácidos alfa, y también aquí nos centraremos en ellos.
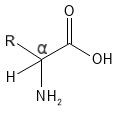
Figura 1 Estructura química general de un alfa-aminoácido. Obsérvese el átomo de carbono α marcado con los cuatro enlaces al grupo carboxilo (-COOH), la cadena lateral R, el grupo amina (-NH2) y el átomo H, que se indica aquí para que se vean los cuatro enlaces con mayor claridad (normalmente el átomo H no se indicaría en una fórmula estructural como esta).
En los alfa-aminoácidos, el átomo alfa-C suele tener cuatro grupos/átomos diferentes unidos a él: el grupo carboxilo, el grupo amino, la cadena lateral (R) y un átomo de hidrógeno. Dos aminoácidos concretos en esta estructura son la prolina, cuyo grupo amino y átomo alfa-C forman parte de un anillo de 5 miembros, por lo que el grupo amino es una amina secundaria y no hay átomo H en el átomo alfa-C; y la glicina, cuyo grupo R es un átomo H (y por tanto no tiene átomo alfa-C con cuatro enlaces diferentes). Con excepción de la glicina, los 20 aminoácidos estándar pueden formar dos estructuras espaciales diferentes, que son imágenes especulares entre sí: isómeros L y D. Esto se debe a que el átomo alfa-C tiene cuatro enlaces diferentes y, por tanto, actúa como estereocentro; los dos isómeros también se denominan enantiómeros. Aparte de la glicina, que no tiene estereocentro, los aminoácidos en la naturaleza suelen ser isómeros L. Sin embargo, se han encontrado algunos aminoácidos D en ciertas bacterias, en algunos organismos marinos y también en humanos, donde se ha detectado una pequeña cantidad del aminoácido D-serina.
A pH fisiológico, que normalmente es de 7,35-7,45 para la sangre y alrededor de 7,0-7,4 en el interior de las células, los aminoácidos se encuentran típicamente en forma de zwitteriones, lo que significa que la molécula lleva una carga positiva y negativa al mismo tiempo. La carga positiva está en el grupo amina (-NH3+), mientras que la carga negativa está en el grupo carboxilo (-COO-). A menudo, en la literatura se ven estructuras químicas sin esta distribución de carga dependiente del pH.
Aminoácidos: propiedades y clasificación
Las cadenas laterales de los aminoácidos son las que les confieren sus diferentes estructuras químicas y, por tanto, sus distintas propiedades, que también se reflejan en los péptidos y proteínas de los que forman parte.
Los aminoácidos pueden clasificarse de distintas maneras en función de sus propiedades. Las propiedades fisicoquímicas incluyen, por ejemplo, las propiedades ácido-base, carga, polaridad y solubilidad. La mayoría de los aminoácidos son hidrosolubles y, por lo general, polares, pero en distintos grados según la cadena lateral. Algunos de los aminoácidos tienen una cadena lateral no polar e hidrófoba, lo cual es importante, por ejemplo, para su ubicación dentro de las proteínas. Como ya se ha mencionado, la mayoría de los aminoácidos son zwitteriones a pH fisiológico, pero algunos de ellos también pueden tener una carga en su cadena lateral en función del pH del entorno, y así tener una carga global positiva o negativa. Los grupos funcionales de la cadena lateral, como un grupo OH, un átomo de azufre, un átomo de nitrógeno o una estructura en forma de anillo, también son importantes para las propiedades fisicoquímicas y biológicas del aminoácido y la proteína.
Desde una perspectiva nutricional y biológica, los aminoácidos se clasifican en tres grupos:
-
Aminoácidos esenciales que el organismo no puede producir (en cantidad suficiente) por sí mismo, y que por tanto deben obtenerse a través de la dieta. En el caso de los seres humanos, suele tratarse de nueve aminoácidos: histidina, isoleucina, leucina, lisina, metionina, fenilalanina, treonina, triptófano y valina.
Aminoácidos condicionalmente esenciales, también llamados semiesenciales, que normalmente el organismo produce en cantidad suficiente, pero cuya necesidad no puede cubrir en determinadas circunstancias, por lo que es necesario incorporarlos a través de la dieta. Esto puede ocurrir en periodos de crecimiento rápido (lactantes), o en caso de embarazo, enfermedad o traumatismo. Las necesidades alimentarias específicas de aminoácidos dependen de varios factores, como la fase de desarrollo, la genética, el estado fisiológico, la microbiota intestinal, y las condiciones ambientales y patológicas. Sin embargo, en todas las fuentes se suelen destacar seis aminoácidos pertenecientes a este grupo: arginina, cisteína, glutamina, glicina, prolina y tirosina.
-
Aminoácidos no esenciales que el organismo normalmente produce en cantidad suficiente. Este grupo suele incluir los cinco aminoácidos siguientes: alanina, asparagina, ácido aspártico, ácido glutámico y serina.
La clasificación de los aminoácidos no está del todo clara en la literatura científica. Por ejemplo, algunas fuentes califican la histidina como aminoácido esencial, mientras que otras la describen como semiesencial. La clasificación anterior es la que se encuentra más con mayor frecuencia en la literatura. Las carencias de aminoácidos esenciales pueden acarrear graves consecuencias para la salud y provocar síntomas muy diversos, lo que refleja las múltiples funciones que desempeñan aminoácidos en el organismo. Por ejemplo, una ingesta insuficiente de aminoácidos esenciales puede provocar depresión, ansiedad, insomnio, fatiga, reducción del crecimiento y del desarrollo mental en los niños.
Los 20 aminoácidos estándar
A continuación presentamos los 20 aminoácidos en orden alfabético junto con sus fórmulas estructurales tal y como serían a pH fisiológico. Para cada aminoácido se indican las abreviaturas de tres letras y una letra (entre paréntesis), y se destacan las propiedades más importantes y sus funciones biológicas.
Alanina (Ala, A)
La alanina es un aminoácido no esencial que desempeña un papel fundamental en el metabolismo energético. Forma parte del llamado ciclo glucosa-alanina, en el que los músculos y el hígado colaboran para equilibrar las necesidades energéticas y la excreción de nitrógeno. Cuando los músculos descomponen los aminoácidos durante el ejercicio, se forma alanina, que se transporta al hígado, donde se utiliza para producir glucosa. Este mecanismo garantiza que los músculos puedan mantener el suministro de energía evitando que se acumule amoníaco tóxico (NH3).
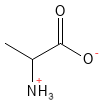
Figura 2 Fórmula estructural química de la alanina
Arginina (Arg, R)
La arginina es un aminoácido semiesencial para el ser humano, aunque los lactantes y las personas que padecen ciertas enfermedades o estrés requieren su ingesta alimentaria. Para determinados grupos de animales, como las aves, los gatos y los perros, la arginina es esencial. La arginina interviene en una amplia gama de procesos, como la división celular, la cicatrización de heridas, la función inmunitaria y la presión arterial. Es un precursor del óxido nítrico (NO), que tiene un efecto vasodilatador y, por tanto, puede reducir la presión arterial. Además, la arginina interviene en la formación de creatina (una importante fuente de energía para los músculos) y en el ciclo de la urea, que elimina el exceso de amoníaco del organismo. Clínicamente, la suplementación con arginina ha demostrado efectos positivos en la cicatrización de heridas.
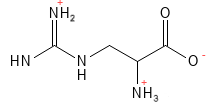
Figura 3 Fórmula química estructural de la arginina, uno de los aminoácidos básicos con carga positiva en la cadena lateral. Este aminoácido es el que tiene más átomos de nitrógeno, y puede hidrolizar dos de ellos para formar urea, que es la forma que tiene el organismo de excretar el amoníaco, un desecho tóxico que se produce al metabolizar las proteínas.
Asparagina (Asn, N)
La asparagina es un aminoácido no esencial y actúa como un importante transportador de nitrógeno en el metabolismo y la síntesis de proteínas. Es especialmente importante para el sistema nervioso, donde desempeña un papel especial en el desarrollo y el funcionamiento del cerebro.
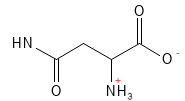
Figura 4 Fórmula estructural química de la asparagina.
Ácido aspártico (Asp, D)
El ácido aspártico y su correspondiente forma con carga negativa, el aspartato, que es la forma habitual a pH fisiológico, es uno de los aminoácidos no esenciales. Es fundamental para el metabolismo energético y actúa como precursor de algunos nucleótidos del ARN y el ADN, y de otros aminoácidos como la asparagina, la metionina y la lisina. Además, este aminoácido interviene en el ciclo de la urea y desempeña un papel importante en la energía del organismo, la división celular y la utilización del nitrógeno.
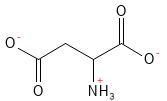
Figura 5 Fórmula estructural química del aspartato. A pH fisiológico, el ácido aspártico ha cedido su átomo H del grupo carboxilo de la cadena lateral, lo que le confiere una carga negativa y el nombre de aspartato.
Cisteína (Cys, C)
La cisteína es un aminoácido que contiene azufre y que puede formarse a partir de la metionina, pero en determinadas condiciones (por ejemplo, en lactantes, o en caso de enfermedad) puede ser necesario un aporte adicional a partir de la alimentación; por ello se considera un aminoácido semiesencial. Presenta una propiedad química especial, ya que dos moléculas de cisteína pueden formar un enlace covalente disulfuro. Estos enlaces actúan como «ganchos moleculares» que estabilizan la estructura tridimensional de las proteínas, una característica crucial de la queratina de la piel, el cabello y las uñas. La cisteína también forma parte del tripéptido antioxidante glutatión, un antioxidante muy importante que se produce en la mayoría de los organismos que consumen oxígeno4.
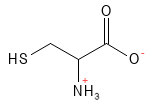
Figura 6 Fórmula química estructural de la cisteína. Con su átomo de azufre, puede formar un enlace disulfuro con otro aminoácido cisteína, y esta molécula de dos aminoácidos se denomina cistina. El enlace disulfuro entre dos moléculas de cisteína también es importante en la estructura de las proteínas, por ejemplo, en la queratina.
Ácido glutámico (Glu, E)
El ácido glutámico y su correspondiente forma con carga negativa, el glutamato, que es la forma habitual a pH fisiológico, es un aminoácido no esencial. Tiene especial importancia en el cerebro, donde actúa como neurotransmisor y como precursor del neurotransmisor GABA (ácido gamma-aminobutírico), que es un importante neurotransmisor inhibidor. El glutamato, al igual que la cisteína, forma parte del tripéptido antioxidante glutatión. Además, el glutamato contribuye a dar a los alimentos un sabor umami.
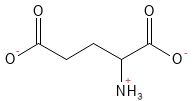
Figura 7 Fórmula estructural química del glutamato. A pH fisiológico, el ácido glutámico ha cedido su átomo H en el grupo carboxilo de la cadena lateral, lo que le da una carga negativa y el nombre de glutamato.
Glutamina (Gln, Q)
La glutamina es uno de los aminoácidos semiesenciales, ya que, por ejemplo, en situaciones de traumatismo, enfermedad o durante la etapa de lactancia, puede ser necesaria en cantidades mayores de las que el organismo es capaz de producir. Desempeña un papel clave en la regulación ácido-base del organismo, especialmente en los riñones, y es importante para la síntesis de lípidos y nucleótidos. La glutamina también es un importante transportador de nitrógeno entre los tejidos y el hígado, y contribuye a retirar el amoníaco del tejido.
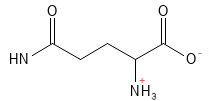
Figura 8 Fórmula estructural química de la glutamina.
Glicina (Gly, G)
La glicina es el aminoácido más simple y pequeño, por lo que es muy flexible en las estructuras proteicas. Es un aminoácido semiesencial (aunque algunas publicaciones lo clasifican como no esencial) y desempeña un papel muy importante en el organismo: por ejemplo, constituye alrededor del 35 % del colágeno. Además, es un neurotransmisor del sistema nervioso central y forma parte del tripéptido antioxidante glutatión. También proporciona un sabor suave y dulce, lo que se aprovecha en la producción de diversos alimentos.
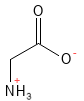
Figura 9 Fórmula química estructural de la glicina, el aminoácido más simple y pequeño de todos.
Histidina (His, H)
En general, se considera que la histidina es un aminoácido esencial, aunque en parte de la literatura se clasifica como semiesencial. Este aminoácido es un precursor de la histamina, un neurotransmisor fundamental en la respuesta inmunitaria y las reacciones alérgicas, y como neurotransmisor. Al igual que la arginina y la lisina, a pH fisiológico tiene carga positiva.
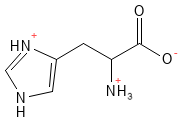
Figura 10 Fórmula química estructural de la histidina, uno de los aminoácidos básicos con carga positiva en la cadena lateral.
Isoleucina (Ile, I)
La isoleucina es un aminoácido esencial y es, junto con la leucina y la valina, uno de los llamados aminoácidos de cadena ramificada (BCAA: por sus siglas en inglés). Contribuye al metabolismo energético de los músculos y a la regulación del azúcar en sangre. La isoleucina también es importante en la hemoglobina, la proteína que transporta el oxígeno en la sangre.
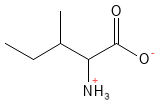
Figura 11 Fórmula química estructural de la isoleucina, uno de los aminoácidos con cadena lateral ramificada (BCAA).
4Encontrará más información sobre antioxidantes en nuestro sitio
Leucina (Leu, L)
La leucina es un aminoácido esencial y uno de los tres aminoácidos de cadena ramificada (BCAA: por sus siglas en inglés). Es especialmente importante para el tejido muscular, ya que estimula la síntesis de proteínas e inhibe la degradación de las proteínas musculares. La leucina también interviene en la regulación del azúcar en sangre y es un potenciador natural del sabor de los alimentos.
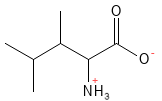
Figura 12 Fórmula química estructural de la leucina, un aminoácido con cadena lateral ramificada, los llamados BCAA.
Lisina (Lys, K)
La lisina es un aminoácido esencial y uno de los tres aminoácidos con carga positiva a pH fisiológico. Desempeña un papel central en varios procesos vitales. Por ejemplo, la lisina es necesaria para la formación de colágeno, interviene en el metabolismo de los ácidos grasos y en la regulación epigenética de la expresión génica mediante modificaciones químicas de las histonas5. También favorece la absorción del calcio.
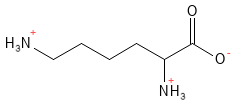
Figura 13 Fórmula química estructural de la lisina, un aminoácido básico con carga positiva en la cadena lateral.
Metionina (Met, M)
La metionina es un aminoácido esencial que contiene azufre y actúa como precursor de otras biomoléculas. Entre otras funciones, es un precursor para la formación de cisteína y S-adenosilmetionina (SAM-e), un importante aportador de metilo en muchas reacciones bioquímicas, incluida la metilación6 del ADN y las proteínas. La metionina se ha utilizado en el tratamiento de las enfermedades hepáticas y la depresión, y su deficiencia puede provocar la pérdida de color del cabello.
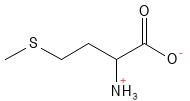
Figura 14 Fórmula estructural química de la metionina.
Fenilalanina (Phe, F)
La fenilalanina es un aminoácido esencial que tiene gran importancia como precursor de la tirosina. A partir de ella, pueden producirse varios neurotransmisores importantes, como la dopamina, la adrenalina y la noradrenalina, así como el pigmento melanina, que contribuye al color de la piel y a la protección frente a los rayos solares. La fenilalanina se utiliza en el tratamiento de la depresión y el dolor crónico.
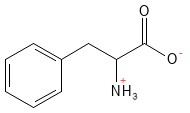
Figura 15 Fórmula estructural química de la fenilalanina.
Prolina (Pro, P)
La prolina es un aminoácido no esencial, y muy peculiar, ya que su cadena lateral forma una estructura anular con el propio grupo amino, lo que le confiere un papel especial en las estructuras proteicas. Este aminoácido es fundamental para la formación de colágeno, ya que la prolina y la hidroxiprolina constituyen una parte esencial de la estructura del colágeno.
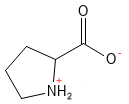
Figura 16 Fórmula estructural química de la prolina. Obsérvese cómo la cadena lateral forma una estructura de anillo de 5 miembros con el grupo amina, que se convierte en una amina secundaria. La prolina es más rígida que otros aminoácidos.
Serina (Ser, S)
La serina es un aminoácido no esencial que se aisló por primera vez de la seda, un material especialmente rico en este compuesto. Desempeña un papel importante en la función cerebral y participa en la síntesis de nucleótidos, que son los componentes básicos del ADN y el ARN. La serina también es precursora de otros aminoácidos, como la glicina y la cisteína, y participa en la biosíntesis del folato (vitamina B9).
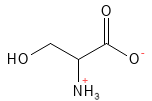
Figura 17 Fórmula estructural química de la serina.
Treonina (Thr, T)
La treonina es un aminoácido esencial y el último de los 20 aminoácidos estándar en ser descubierto (en 1935). Interviene en la formación de colágeno y elastina, por lo que es importante para la estructura cutánea y el tejido conjuntivo.
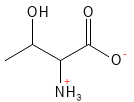
Figura 18 Fórmula química estructural de la treonina.
Triptófano (Trp, W)
El triptófano es un aminoácido esencial conocido por su papel como precursor de varias moléculas biológicamente activas. Entre otras cosas, se convierte en el neurotransmisor serotonina, que regula el estado de ánimo y el sueño, y en la hormona melatonina, que controla el ritmo circadiano. El triptófano también es una fuente de la vitamina B3 niacina.
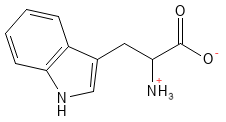
Figura 19 Fórmula química estructural del triptófano, el aminoácido estándar más grande de los 20 aminoácidos estándar.
Tirosina (Tyr, Y)
La tirosina es un aminoácido no esencial, ya que puede formarse a partir de la fenilalanina. Es biológicamente muy importante porque es un precursor de varias sustancias de señalización y hormonas, incluido el neurotransmisor dopamina, que puede convertirse en las hormonas noradrenalina (norepinefrina) y adrenalina (epinefrina). La tirosina también interviene en la formación de importantes hormonas metabólicas producidas en la glándula tiroides y en la síntesis del pigmento de melanina feomelanina, que da color a la piel y al cabello y ayuda a proteger de los rayos solares.
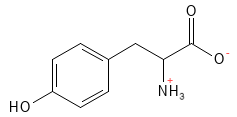
Figura 20 Fórmula estructural química de la tirosina.
Valina (Val, V)
La valina es un aminoácido esencial y uno de los tres aminoácidos de cadena ramificada (BCAA: por sus siglas en inglés). Interviene en la regulación del azúcar en sangre, el equilibrio energético y el metabolismo muscular, donde tiene un efecto estimulante de la síntesis proteica.
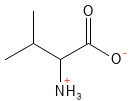
Figura 21 Fórmula química estructural de la valina, uno de los aminoácidos con cadena lateral ramificada, los llamados BCAA.
5Las histonas son proteínas especiales alrededor de las cuales se pliega el ADN, y que participan en la regulación de los genes.
6La metilación es el proceso de añadir un grupo metilo (-CH3) a una molécula. Por ejemplo, este proceso es importante en la regulación de la expresión génica, es decir, la regulación epigenética.
Aminoácidos y biología de la piel
Los aminoácidos desempeñan un papel fundamental en la estructura y el funcionamiento de la piel. Son los componentes básicos de todas las proteínas, como la elastina y el colágeno, que constituyen las estructuras proteicas básicas de la piel y contribuyen a su resistencia, elasticidad, cicatrización de heridas, entre otros. La piel también contiene péptidos antimicrobianos (AMP), que son un componente clave del sistema inmunitario cutáneo, regulan el microbioma de la piel y la defensa frente a microorganismos extraños.
Una parte importante del balance de líquidos de la piel depende de los llamados Factores Naturales de Hidratación (NMF, por sus siglas en inglés), formados en alrededor del 40 % por aminoácidos y sus derivados.
Los NMF consisten en una mezcla de sales, urea, electrolitos y aminoácidos derivados principalmente de la degradación proteica de la filagrina7. La serina (alrededor del 36 %), la glicina (22 %) y la alanina (13 %) son los aminoácidos más comunes en los NMF, pero la arginina también resulta relevante. La composición puede variar entre las distintas zonas de la piel; por ejemplo, se observa un menor contenido de serina en la mejilla y la mandíbula.
Además de su papel en los NMF, se ha demostrado que los aminoácidos y ciertos péptidos pequeños afectan más directamente a la biología de la piel.
Los estudios sugieren que el consumo de aminoácidos o péptidos específicos puede favorecer la síntesis de colágeno, la cicatrización de heridas e incluso aumentar la hidratación y elasticidad de la piel. Por ejemplo, se ha demostrado que algunos péptidos estimulan la producción de ácido hialurónico en los queratinocitos, mientras que la suplementación oral de dipéptidos de glicina y leucina ha mejorado la hidratación de la piel tras la exposición a los rayos UVB en estudios con animales.
En los productos cosméticos, los aminoácidos y sus sales se utilizan como ingredientes hidratantes y para elaborar otros ingredientes. Los aminoácidos suelen producirse por fermentación, catálisis enzimática o hidrólisis de proteínas, y algunos (como la glicina) también pueden sintetizarse químicamente.
Los aminoácidos son mucho más que los componentes básicos de las proteínas: son fundamentales para el crecimiento, el desarrollo y los procesos bioquímicos del organismo, y desempeñan un papel clave en la estructura y la función de la piel.
7La filagrina es una proteína importante de la epidermis (la capa más externa de la piel) que es crucial para la función de barrera de la piel, el pH y la capacidad de retener la humedad. Encontrará más información sobre la filagrina en nuestro sitio
Fuentes
- Akram, M. et. Al. Amino acids: A review article. Journal of Medicinal Plants Research, 2011; 5(17), 3997–4004.
- Alberts B, Johnson A, Lewis J, et al. Molecular Biology of the Cell. 4th edition. New York: Garland Science; 2002. From RNA to Protein. Lokaliseret 22. August 2025: https://www.ncbi.nlm.nih.gov/books/NBK26829/.
- Arezki, N.R.; Williams, A.C.; Cobb, A.J.; & Brown, M.B. Design, synthesis and characterization of linear unnatural amino acids for skin moisturization. International Journal of Cosmetic Science. 2017; 39(1):72-82.
- CIR Expert Panel. Safety assessment of alpha-amino acids. International Journal of Toxicology, 2013; 32(6 Suppl), 59S–123S.
- Diaz I, Namkoong J, Wu J, Giancola G. Amino acid complex (AAComplex) benefits in cosmetic products: In vitro and in vivo clinical studies. Journal of Cosmetic Dermatology, 2022; 21:3046–3052.
- Fluhr, J.W.; Darlenski, R.; & Surber, C. Glycerol and the skin: holistic approach to its origin and functions. The British journal of dermatology. 2008; 159(1): 23-34.
- Gad, M. Z. Anti-aging effects of l-arginine. Journal of Advanced Research, 2010; 1(3), 169–177.
- Kamble, C.; Chavan, R.; & Kamble, V. A review on amino acids. Research & Reviews: A Journal of Drug Design and Discovery, 2022; 9(1), 1–10.
- Lopez, M.J.; & Mohiuddin, S.S. Biochemistry, Essential Amino Acids. [Updated 2024 Apr 30]. I: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. Lokaliseret 22. August 2025.
- Murakami, H.; Shimbo, K.; Inoue, Y.; Takino, Y.; & Kobayashi, H. Importance of amino acid composition to improve skin collagen protein synthesis rates in UV-irradiated mice. Amino Acids. 2012; 42(6):2481-2489.
- National Institute of General Medical Sciences. (2011, October 27). The structures of life. Chapter 1: Proteins are the body’s worker molecules.S. Department of Health & Human Services. Lokaliseret 22. August 2025: https://especialidades.sld.cu/histologia/files/2020/06/Booklet-The-Structures-of-Life.pdf.
- Nelson, D. L., & Cox, M. M. Lehninger Principles of Biochemistry (7th ed.). W. H. Freeman and Company; 2017.
- Nie, C., He, T., Zhang, W., Zhang, G., & Ma, X. Branched chain amino acids: Beyond nutrition metabolism. International Journal of Molecular Sciences, 2018; 19(4), 954.
- Nishiguchi, A., Matsumura, T., & Yoshikawa, M. Oral administration of glycine and leucine dipeptides improves skin hydration and elasticity in UVB-irradiated mice. Biomolecules & Therapeutics, 2017; 25(5), 528–534.
- PubChem Sketcher V2.4. Lokaliseret 11. September 2025: https://pubchem.ncbi.nlm.nih.gov
- Wikipedia websites: Amino acid; Aminosyre; Essential amino acid; Alanine; Arginine; Asparagine; Aspartic acid; Cysteine; Glutamine; Glutamic acid; Glycine; Histidine; Isoleucine; Leucine; Lysine; Methionine; Phenylalanine; Proline; Serine; Threonine; Tryptophan; Tyrosine; Valine. Lokaliseret 20. August 2025.
- Wu, G. Functional amino acids in nutrition and health. Amino Acids, 2013; 45(3), 407–411.
